ENFERMEDADES NEURODEGENERATIVAS
Identificada una enzima ‘natural’ capaz de prevenir y revertir el alzhéimer y el párkinson
La enzima Cyp40 humana es capaz de deshacer los ovillos neurofibrilares de proteína tau y los agregados de alfa-sinucleína causantes de estas enfermedades
A. OTERO
El alzhéimer y el párkinson son dos enfermedades caracterizadas por la presencia en el cerebro de agregados de proteínas defectuosas –están mal plegadas, por lo que su estructura es inadecuada– que resultan altamente tóxicos para las neuronas. Unos agregados insolubles que, denominados cuerpos ‘amiloides’ o ‘amiláceos’, son comunes a la inmensa mayoría de enfermedades neurodegenerativas y que en el caso del alzhéimer y del párkinson están formados por la unión de, respectivamente, la proteína tau y la proteína alfa-sinucleína. En consecuencia, y en aras de prevenir el daño neuronal, la mayoría de investigaciones para tratar estas enfermedades tienen por objetivo hallar un fármaco capaz de ‘deshacer’ estos cuerpos amiloides. Sin embargo, es posible que no haya que ir demasiado lejos. Y es que como muestra un estudio llevado a cabo por investigadores de la Universidad del Sur de Florida en Tampa (EE.UU.), el propio cuerpo humano ya contiene una enzima capaz de hacerlo, y de forma muy eficaz: la ciclofilina 40 (Cyp40).
Noticias relacionadas
Como explica Laura Blair, directora de esta investigación publicada en la revista « PLOS Biology », « el hallazgo de que Cyp40 puede ‘desenredar’ los agregados de proteína tau y de alfa-sinucleína sugiere que este enzima, o cualquiera de las otras 40 proteínas humanas con una actividad similar, puede jugar un papel en el tratamiento de las enfermedades neurodegenerativas ».
Hacer y deshacer
La proteína tau y la alfa-sinucleína, tal y como sucede en la mayoría de las proteínas que se agregan para forma cuerpos amiloides, presentan en su composición el aminoácido prolina, cuya estructura es responsable de incluir las curvas o giros en la cadena proteínica para posibilitar su plegamiento. El problema es que estas curvaturas también facilitan la adhesión entre sí de las regiones adyacentes de la proteína, promoviendo así un plegamiento inadecuado y, por ende, la formación de cuerpos amiloides.
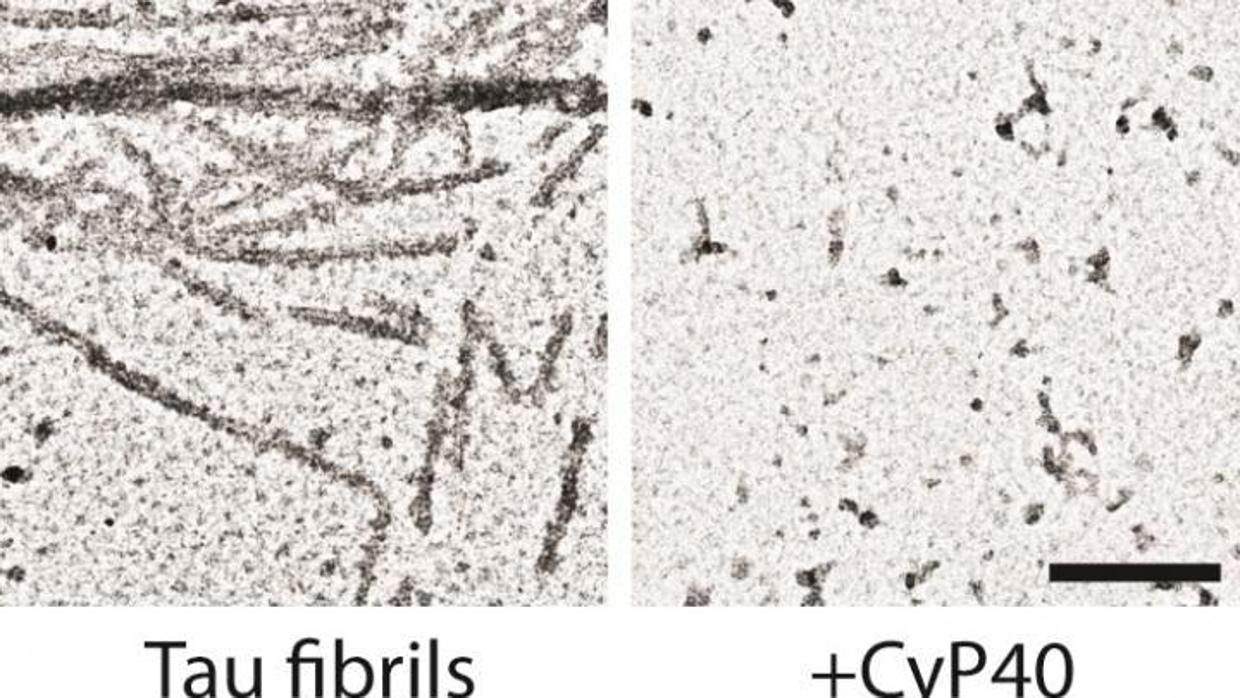
Y llegados a este punto, ¿qué papel juega Cyp40 en este proceso? Pues es la responsable de unirse a la prolina durante el plegamiento normal de la proteína y de conferir a la cadena sus curvas o dobleces . Siempre en condiciones normales. Pero como ocurre con la mayoría de las enzimas, igual que puede hacerlo, puede deshacerlo y desdoblar la proteína.
Nuestro estudio demuestra que la enzima Cyp40 puede ‘desenredar’ los agregados de proteína tau y de alfa-sinucleína
Laura Blair
En nuevo estudio fue llevado a cabo con un modelo animal –ratones– de enfermedad de Alzheimer al que manipularon genéticamente para que expresara la Cyp40 humana. Y de acuerdo con los resultados, la enzima fue capaz de reducir la cantidad ‘ovillos neurofibrilares’ –o lo que es lo mismo, de agregados’– de proteína tau, a la que convirtió en una forma mucho más soluble. En consecuencia, y dado que la enzima protegió a las neuronas cerebrales de la toxicidad de los agregados, los animales experimentaron una mejoría muy significativa de sus capacidades cognitivas .
Finalmente, los autores repitieron el experimento con un segundo modelo animal –ratones– de enfermedad de Parkinson. Y una vez más, observaron que la Cyp40 humana fue muy eficaz a la hora de ‘deshacer’ los agregados tóxicos, en este caso formados por la unión de alfa-sinucleína defectuosa. En consecuencia, destacan los autores, «esta es la primera vez que se muestra la desagregación de un cuerpo amiloide responsable de una enfermedad neurodegenerativa por Cyp40 ».
Nueva estrategia terapéutica
La verdad es que aún no se sabe qué hace Cyp40 para reducir la cantidad de agregados cerebrales de proteínas defectuosas. Los autores creen que la enzima puede unirse a las proteínas y deshacer las ‘dobleces’ en los puntos en los que se encuentra la prolina, ayudando así a separar las regiones de la cadena que se encontraban unida. Pero también existe la posibilidad de que Cyp40 se una a las proteínas antes de que se unan para formar los agregados, previniendo así su toxicidad sobre las neuronas.
Sea como fuere, concluye Laura Blair, « nuestro hallazgo puede abrir la puerta al desarrollo de una nueva estrategia terapéutica para el abordaje de estas enfermedades ».
Esta funcionalidad es sólo para registrados
Iniciar sesión