MEDICINA REGENERATIVA
Crean minintestinos funcionales a partir de células madre humanas
Trasplantados en ratas, los segmentos tienen la capacidad de liberar nutrientes al torrente circulatorio de una forma totalmente natural
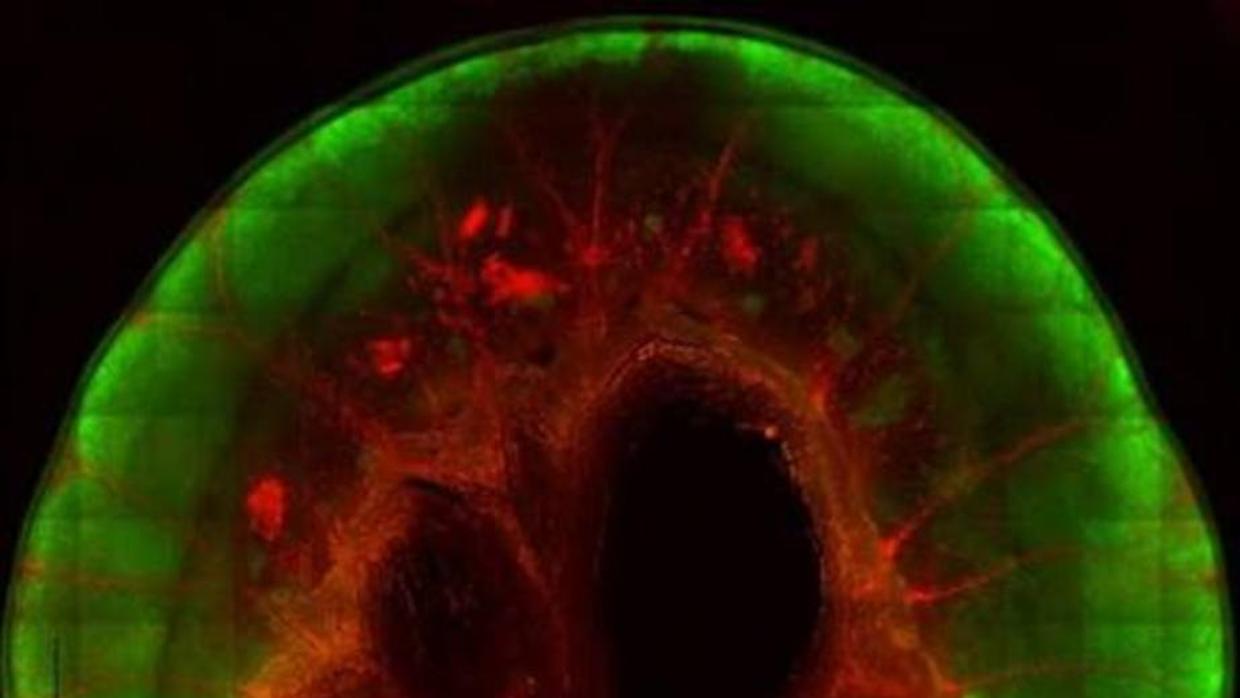
Las células madre pluripotentes inducidas (iPS) representan, según la opinión de numerosos expertos, el futuro de la medicina regenerativa. No en vano, estas iPS tienen la capacidad de diferenciarse en cualquier tipo de célula del organismo, por lo que, cuando menos en teoría, pueden ser utilizadas para crear órganos y tejidos sanos con los que reemplazar a aquellos deteriorados por una lesión o enfermedad o, simplemente, por el paso de los años. De hecho, en los últimos años ya se han desarrollado distintos ‘organoides’ –esto es, de estructuras tridimensionales que imitan lo que sucede en un órgano– a partir de iPS humanas, caso entre otros de ‘mini-retinas’, ‘mini-estómagos’ o ‘mini-hígados’. Y ahora, investigadores del Hospital General de Massachusetts en Boston (EE.UU.) han dado un paso más allá al lograr ‘crear’ a partir de estas células madre segmentos del intestino delgado que, una vez trasplantados en un modelo animal –ratas–, tienen la capacidad de liberar nutrientes al torrente circulatorio. O lo que es lo mismo, son capaces de llevar a cabo, si bien parcialmente, la digestión.
Noticias relacionadas
Como explica Harald Ott, director de esta investigación publicada en la revista « Nature Communications », «en nuestro trabajo hemos sido capaces de cerrar la brecha entre la diferenciación celular –promoviendo que las células madre se transformen en un tipo específico de célula– y la generación de un tejido que muestra una funcionalidad de alto nivel, como sería en este caso la perfusión vascular y la absorción de nutrientes. Así, y si bien estudios previos han documentado la diferenciación exitosa de organoides a partir de iPS, nuestro trabajo describe una tecnología que posibilita que estas pequeñas unidades de tejido formen injertos de mayor escala que un día podrían usarse para el reemplazo de órganos ».
‘Descelularización’
La extirpación quirúrgica de segmentos del intestino delgado es una práctica que debe acometerse hoy en día en el tratamiento de algunos pacientes con enfermedades gastrointestinales graves, caso entre otras la enfermedad de Crohn. El resultado es que los pacientes intervenidos padecen un trastorno denominado ‘síndrome del intestino corto’ y, en muchos casos, se ven abocados a alimentarse por vía intravenosa. Sin embargo, existe una solución para paliar este síndrome de intestino corto: el trasplante de intestino delgado. Pero hay un problema: el número de donantes es siempre insuficiente para suplir la demanda de trasplantes . Es decir, hace falta una fuente alternativa de órganos –en este caso, de intestinos– para poder responder a las necesidades de los pacientes susceptibles de someterse a un trasplante.
La técnica empleada en el estudio consiste en coger un órgano y administrar un detergente para eliminar todas las células –un proceso denominado ‘descelularización’–, lo que da como resultado un ‘órgano hueco’ o, lo que es lo mismo, una estructura o andamio del órgano formado por la matriz extracelular que puede ‘rellenarse’ nuevamente con las células apropiadas. Y si bien los autores ya habían empleado previamente esta técnica para generar pulmones y riñones en modelos animales –ratas– e, incluso, regenerar células del miocardio en corazones humanos descelularizados, en el nuevo trabajo la emplearon para descelularizar segmentos de 4 centímetros de intestino delgado de ratas.
Los segmentos a partir de iPS humanas podrían algún día ofrecer una alternativa más accesible que los trasplantes de intestino delgado
Harald Ott
Lógicamente, la dificultad de la técnica no se encuentra tanto en lograr una estructura hueca del órgano como en rellenarla, lo que requiere la generación a partir de células madre de células epiteliales para la pared intestinal y de células endoteliales para los vasos sanguíneos. Así, lo que hicieron los autores fue promover la diferenciación de iPS humanas en células precursoras intestinales y colocarlas en los segmentos descelularizados . Y posteriormente, una vez formada la capa de epitelio al cabo de dos semanas, ‘repoblaron’ los canales vasculares con células endoteliales humanas generadas a partir de las iPS. El resultado es un ‘prototipo’ de segmento de intestino delgado que deberá ser introducido en un biorreactor de perfusión para su maduración –lo que se logra al cabo de tan solo siete días.
Pero una vez madurados, ¿estos segmentos son realmente funcionales? Pues sí. Los experimentos in vitro constataron el paso de sangre a través de los nuevos vasos sanguíneos y la transferencia de glucosa y ácidos grasos desde el interior de los segmentos al torrente circulatorio. Además, las células epiteliales que repoblaron las paredes de los segmentos mostraron la misma estructura polarizada que se observa en los epitelios intestinales naturales.
Fuente ilimitada
Finalmente, los autores unieron algunos de los segmentos intestinales ‘repoblados’ a las arterias carótidas y las venas yugulares de ratas, observando cómo los vasos sanguíneos de los segmentos se llenaban inmediatamente de sangre y cómo las inyecciones de glucosa y ácidos grasos administrados a las cuatro semanas en los segmentos daban lugar a un incremento de los niveles sanguíneos de azúcar y lípidos de los animales –un resultado que confirmó la absorción de nutrientes–. Es más; los segmentos también presentaron algunos tipos de células típicas de las paredes intestinales que, sin embargo, no se detectaron durante su ‘repoblación’ y cultivo, lo que indica que el proceso de maduración del tejido continúa una vez es transferido a un animal vivo.
Como concluye Harald Ott, «nuestros experimentos con animales vivos muestran que las iPS humanas diferenciadas en células intestinales pueden ensamblarse en un injerto intestinal con un alto nivel de organización y conectadas a la vasculatura de un receptor para permitir la absorción de nutrientes. El próximo paso será lograr una mayor maduración de los injertos y adaptarlos al tamaño del ser humano, para que así puedan algún día ofrecer una alternativa más accesible que los trasplantes de intestino delgado para los pacientes con el síndrome de intestino corto. Además, estos injertos específicos para cada paciente y ‘a demanda’ no requerirán, al menos en teoría, el uso de fármacos inmunosupresores ».